Obaja chemické zlúčeniny pretože chemické prvky sú tvorené molekulami a tieto sú zase tvorené atómami. Atómy zostávajú zjednotené vďaka vzniku tzv chemické odkazy.
The chemické väzby nie sú všetky rovnaké: v podstate závisia od elektronických charakteristík zúčastnených atómov. Existujú dva najbežnejšie typy odkazov: iónové väzby a Kovalentné väzby.
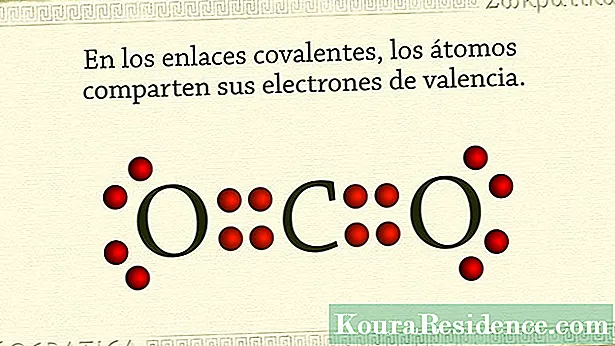
Kovalentné väzby sú zvyčajne tie, ktoré držať pokope nekovové atómy. Stáva sa, že atómy týchto prvkov majú vo svojom najvzdialenejšom obale veľa elektrónov a majú tendenciu zadržiavať alebo získavať elektróny namiesto toho, aby sa ich vzdali.
To je dôvod, prečo spôsob, akým tieto látky alebo chemické zlúčeninyicos dosahujú stabilitu zdieľaním dvojice elektrónov, unie z každého atómu. Takto je zdieľaný pár elektrónov spoločný pre dva atómy a súčasne ich drží pohromade. V plyny napríklad šľachtici, toto sa stáva. Aj v halogénových prvkoch.
Keď dôjde k kovalentnej väzbe medzi prvkami podobnej elektronegativity, napríklad medzi vodíkom a uhlíkom, vytvorí sa väzba nepolárny kovalentný. To sa deje napríklad v uhľovodíkoch.
Rovnako tak vždy vznikajú homonukleárne molekuly (tvorené rovnakým atómom) nepolárne dlhopisy. Ale ak dôjde k väzbe medzi prvkami s odlišnou elektronegativitou, vytvorí sa v jednom atóme vyššia elektrónová hustota ako v druhom, v dôsledku čoho sa vytvorí pól.
Tretia možnosť je, že dva atómy zdieľajú pár elektrónov, ale že k týmto zdieľaným elektrónom prispieva iba jeden atóm. V takom prípade hovoríme o datívna alebo koordinujúca kovalentná väzba.
Pre datívny odkaz Potrebujete prvok s voľným elektrónovým párom (napríklad dusík) a ďalší s nedostatkom elektrónov (napríklad vodík). Je tiež potrebné, aby ten s elektronickým párom bol dostatočne elektronegatívny, aby nestratil elektróny, o ktoré sa chcete deliť. Táto situácia nastáva napríklad v amoniaku (NH4+).
The látok obsahujúce kovalentné zlúčeniny sa môžu vyskytovať v akomkoľvek skupenstve (pevnom, kvapalnom alebo plynnom) a všeobecne sú to zlé vodiče tepla a elektriny.
Často sa ukazujú relatívne nízke teploty topenia a varu Y sú obvykle rozpustné v polárnych rozpúšťadlách, ako benzén alebo tetrachlórmetán, ale majú slabú rozpustnosť vo vode. Sú mimoriadne stabilné.
Je možné uviesť množstvo príkladov zlúčenín alebo látok obsahujúcich kovalentné väzby:
- Fluór
- Bróm
- Jód
- Chlór
- Kyslík
- Voda
- Oxid uhličitý
- Amoniak
- Metán
- Propán
- Kremičitý
- diamant
- Grafit
- Kremeň
- Glukóza
- Parafín
- Diesel
- Dusík
- Hélium
- Freón


